医薬品情報
| 総称名 | セリンクロ |
|---|---|
| 一般名 | ナルメフェン塩酸塩水和物 |
| 欧文一般名 | Nalmefene Hydrochloride Hydrate |
| 製剤名 | ナルメフェン塩酸塩水和物錠 |
| 薬効分類名 | アルコール依存症 飲酒量低減薬 |
| 薬効分類番号 | 1190 |
| ATCコード | N07BB05 |
| KEGG DRUG | D10812 ナルメフェン塩酸塩水和物 |
| JAPIC | 添付文書(PDF) |
添付文書情報2021年11月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| セリンクロ錠10mg | Selincro tablets 10mg | 大塚製薬 | 1190025F1023 | 301.5円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 オピオイド系薬剤(鎮痛、麻酔)を投与中又は投与中止後1週間以内の患者[10.1参照]
2.3 オピオイドの依存症又は離脱の急性症状がある患者[オピオイドの離脱症状(又はその悪化)があらわれるおそれがある。]
4. 効能または効果
アルコール依存症患者における飲酒量の低減
5. 効能または効果に関連する注意
5.1 アルコール依存症の治療目標は、原則、断酒の達成とその継続である。アルコール依存症に伴う精神・身体症状及び患者の意思を総合的に勘案し、断酒ではなく飲酒量低減を治療目標とすることが適切と判断された患者に対して本剤を投与すること。
5.2 アルコール依存症治療の主体は心理社会的治療であることから、服薬遵守及び飲酒量の低減を目的とした心理社会的治療と併用すること。服薬遵守及び飲酒量の低減を目的とした心理社会的治療と併用していない場合の有効性は確立していない。
5.3 アルコール依存症の診断は、国際疾病分類等の適切な診断基準に基づき慎重に実施し、基準を満たす場合にのみ投与すること。
5.4 習慣的に多量飲酒が認められる患者に使用すること。その目安は、純アルコールとして1日平均男性60g超、女性40g超の飲酒量とすること。
5.5 緊急の治療を要するアルコール離脱症状(幻覚、痙攣、振戦せん妄等)を呈している患者では、離脱症状に対する治療が終了してから使用すること。緊急の治療を要するアルコール離脱症状が認められる患者における安全性及び有効性は確立していない。
5.6 飲酒量低減治療の意思のある患者にのみ使用すること。
6. 用法及び用量
通常、成人にはナルメフェン塩酸塩として1回10mgを飲酒の1〜2時間前に経口投与する。ただし、1日1回までとする。なお、症状により適宜増量することができるが、1日量は20mgを超えないこと。
7. 用法及び用量に関連する注意
7.1 服薬せずに飲酒し始めた場合には、気付いた時点で直ちに服薬すること。ただし、飲酒終了後には服薬しないこと。
8. 重要な基本的注意
8.1 注意力障害、浮動性めまい、傾眠等が起こることがあるので、本剤を服用している患者には自動車の運転等危険を伴う機械を操作する際には注意させること。
8.2 アルコール依存症の治療に対して十分な知識・経験を持つ医師のもとで、投与すること。
8.3 本剤との因果関係は明らかではないが、自殺念慮、自殺企図等が報告されているので、患者の状態を十分に観察するとともに、関連する症状があらわれた場合には、本剤の投与を中止するなど適切な処置を行うこと。[9.1.2参照]
8.4 本剤の投与継続及び治療目標の見直しの要否について定期的に検討し、漫然と投与しないこと。国内臨床試験において1年を超える使用経験はない。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 アルコール離脱症状を呈したことのある患者
幻覚、痙攣、振戦せん妄、ふるえ、発汗、睡眠障害等があらわれるおそれがある。
9.1.2 自殺念慮又は自殺企図の既往のある患者、自殺念慮のある患者
自殺念慮、自殺企図があらわれることがある。[8.3参照]
9.2 腎機能障害患者
9.2.1 重度の腎機能障害のある患者(eGFR30mL/min/1.73m2未満)
9.2.2 腎機能障害のある患者(重度の腎機能障害のある患者を除く)
腎機能の低下に伴い血中濃度が上昇するおそれがある。[16.6.1参照]
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者(Child-Pugh分類C)
血中濃度が過度に上昇するおそれがある。重度の肝機能障害のある患者を対象とした臨床試験は実施していない。[7.2参照]
9.3.2 軽度及び中等度の肝機能障害のある患者(Child-Pugh分類A及びB)
9.5 妊婦
アルコール依存症の妊婦又は妊娠している可能性のある女性の治療目標は断酒とすること。治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。アルコール摂取は胎児の発育に影響がある。また、動物実験(ウサギ)において、ナルメフェン投与により、胎児に軽度の発育遅延が報告されている1)。
9.6 授乳婦
アルコール依存症の授乳中の女性の治療目標は断酒とすること。治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が報告されている2)。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
10.1 併用禁忌
[2.2参照] | 本剤によりオピオイド受容体作動薬の離脱症状を起こすおそれがある。また、本剤によりオピオイド受容体作動薬の鎮痛作用を減弱させるため、効果を得るために必要な用量が通常用量より多くなるおそれがある。緊急の手術等によりやむを得ずオピオイド系薬剤を投与する場合、患者毎にオピオイド用量を漸増し、呼吸抑制等の中枢神経抑制症状を注意深く観察すること。また、手術等においてオピオイド系薬剤を投与することが事前にわかる場合には、少なくとも1週間前に本剤の投与を中断すること。本剤を処方する際には、事前に本剤を服用している旨を医療従事者へ伝える必要があることを患者に説明すること。 | 本剤のμオピオイド受容体拮抗作用により、μオピオイド受容体作動薬に対して競合的に阻害する。 |
10.2 併用注意
| 本剤によりオピオイド受容体作動薬の効果を減弱させるため、効果が得られないことがあるので、注意すること。 | 本剤のμオピオイド受容体拮抗作用により、μオピオイド受容体作動薬に対して競合的に阻害する。 |
11. 副作用
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 精神神経系 | 浮動性めまい、傾眠、頭痛、不眠症 | 味覚異常、感覚鈍麻、睡眠の質低下、注意力障害 | 不安、抑うつ、易刺激性、睡眠障害、頭部不快感、無為、健忘、自律神経失調、体位性めまい、異常感覚、知覚過敏、仮面状顔貌、記憶障害、精神的機能障害、ミオクローヌス、鎮静、振戦、激越、無感情、不快気分、リビドー減退、気力低下、気分動揺、パニック発作、落ち着きのなさ、性的興奮障害 | 精神症状(錯乱、幻覚、幻視、幻聴、解離等)注)、リビドー消失、悪夢、緊張、多幸気分、アカシジア、ジスキネジア、錯感覚、片頭痛、麻痺 |
| 循環器 | 動悸、高血圧 | 頻脈、第一度房室ブロック、心室性期外収縮、心電図QT延長、低血圧、起立性低血圧 | 右脚ブロック、不整脈 | |
| 消化器 | 悪心(31.0%)、嘔吐 | 食欲減退、便秘、腹部不快感、腹部膨満、下痢、腹痛 | 口内乾燥、消化不良、流涎過多、口の感覚鈍麻、口の錯感覚、口角口唇炎、食欲亢進 | 胃腸炎、胃腸音異常、口腔知覚不全、硬便、大腸ポリープ、軟便、早期満腹 |
| 血液 | 白血球減少症、白血球数増加、赤血球数減少 | 好中球数減少 | ||
| 内分泌・代謝 | 高プロラクチン血症 | 血中プロラクチン減少、血中トリグリセリド増加、血中カリウム減少、血中ブドウ糖増加、体重増加、高脂血症、尿中ケトン体陽性 | 血中コレステロール増加、体重減少 | |
| 肝臓 | 肝機能異常(AST、ALT、γ-GTP、ALP、血中ビリルビンの増加等) | 慢性肝炎、肝硬変 | ||
| 腎・尿路 | 頻尿 | 尿中血陽性、尿中蛋白陽性、排尿困難 | ||
| 皮膚 | 蕁麻疹、全身性そう痒症、皮膚乾燥、湿疹、せつ、多形紅斑、発疹、丘疹性皮疹 | 全身性皮疹、皮膚炎、血管性浮腫 | ||
| 呼吸器 | 鼻出血、喉頭不快感、息詰まり感、咽喉乾燥、鼻閉、呼吸異常、喘鳴、口腔咽頭不快感、咽頭炎、口腔咽頭痛 | 器質化肺炎、過換気、鼻漏 | ||
| 眼 | 眼乾燥、眼刺激、眼痛、眼瞼浮腫、羞明、動揺視 | 視力障害 | ||
| 生殖器 | 勃起増強、不正子宮出血、勃起不全 | 自発陰茎勃起 | ||
| 耳 | 回転性めまい | 耳鳴、聴力低下、耳不快感 | 一過性難聴、聴覚過敏 | |
| その他 | 倦怠感 | 疲労、口渇、異常感、ほてり、二日酔い | 筋骨格硬直、多汗症、寝汗、冷汗、無力症、不快感、酩酊感、筋骨格不快感、胸部不快感、悪寒、末梢冷感、冷感、熱感、灼熱感、発熱、疼痛、末梢腫脹、過敏症、花粉症、帯状疱疹、関節痛、背部痛、筋痙縮、筋力低下 | 筋緊張、筋固縮、筋肉痛 |
14. 適用上の注意
14.1 薬剤調製時の注意
本剤を分割したり、粉砕したりしないこと。動物実験(マウス)で皮膚感作性が報告されている1)。
14.2 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人に本剤10mg3)及び20mg4)を空腹時単回経口投与した時の血漿中濃度推移及び薬物動態パラメータを図16-1及び表16-1に示す。
図16-1 健康成人における本剤単回投与時のナルメフェンの血漿中濃度推移(平均値±標準偏差)
| 投与量 | tmax(h) | Cmax(ng/mL) | t1/2,Z(h) | AUC∞(ng・h/mL) |
| 10mg | 1.00(0.50〜4.00) | 8.88±3.34 | 12.1±2.1 | 61.8±18.0 |
| 20mg | 1.00(0.50〜3.00) | 25.4±15.7 | 12.3±2.90 | 156±50.7 |
16.1.2 反復投与
健康成人7例に本剤20mgを1日1回5日間反復経口投与した時のAUC24hの累積係数は1.4であった4)。
16.2 吸収
16.2.1 食事の影響
健康成人に本剤20mgを単回経口投与(空腹時又は食後)した時、Cmax及びAUCに食事の影響はみられなかった4)。
16.3 分布
ヒト血漿蛋白結合率は、約30%であった5)(in vitro、限外ろ過法)。
16.4 代謝
ナルメフェンは主にUGT2B7により未変化体のグルクロン酸抱合体に代謝され、一部はCYP3A4/5により脱アルキル化体に代謝される6)(in vitro)。
16.5 排泄
健康成人に14C-ナルメフェン20mgを単回経口投与した時、糞中及び尿中にそれぞれ投与した放射能の20%及び71%が排泄された。未変化体の糞中及び尿中への排泄率は、いずれも投与量の約3%であった7)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能の程度の異なる被験者(eGFR=50〜80mL/min/1.73m2、eGFR=30〜50mL/min/1.73m2及びeGFR<30mL/min/1.73m2)に本剤20mgを単回経口投与した時のAUCは、正常な腎機能を有する被験者と比べてそれぞれ1.1倍、1.4倍及び2.4倍であった8)(外国人データ)。[7.2、9.2.1、9.2.2参照]
16.6.2 肝機能障害患者
肝機能の程度の異なる被験者(Child-Pugh分類A及びB)に本剤20mgを単回経口投与した時のAUCは、正常な肝機能を有する被験者と比べてそれぞれ1.5倍及び2.9倍であった9)(外国人データ)。[7.2、9.3.2参照]
16.6.3 高齢者
本剤の静脈内投与時の薬物動態に年齢による影響は認められなかった10)(外国人データによる母集団解析)。
16.6.4 性別
16.7 薬物相互作用
健康成人に本剤20mgとエタノール0.6g/kg(溶液)を併用で経口投与した時の本剤のCmax及びAUCは、本剤単独投与時と比べてそれぞれ1.2倍及び1.0倍であった。エタノールのCmax及びAUCは、エタノール単独投与時と比べてそれぞれ1.0倍及び1.1倍であった11)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
アルコール依存症患者677例を対象に実施した二重盲検比較試験において、本剤10mg、20mg又はプラセボを心理社会的治療(BRENDA法12))と併用して24週間頓用した。その結果、主要評価項目である多量飲酒日数のベースラインから治療期12週への変化量は、プラセボと比較して統計学的に有意に減少した(p<0.0001)(表17-1)。また、その効果は24週間まで認められた(図17-1)13)。
| 投与群 | 例数 | ベースラインb) | 治療期12週時d) | |
| ベースラインからの変化量c) | プラセボとの差 [95%信頼区間] p値 | |||
| プラセボ | 244 | 22.97±6.44 | −7.91±0.61 | − |
| 本剤10mg | 180 | 23.49±6.07 | −12.09±0.74 | −4.18 [−6.05,−2.32] p<0.0001 |
| 本剤20mg | 242 | 22.64±6.37 | −12.25±0.64 | −4.34 [−6.05,−2.62] p<0.0001 |
図17-1 多量飲酒日数のベースラインからの変化量の推移
MMRM解析により算出した最小二乗平均±標準誤差
HDD数:多量飲酒日数
副作用発現頻度は、本剤10mg群で184例中131例(71.2%)、本剤20mg群で248例中176例(71.0%)であった。主な副作用は、本剤10mg群では悪心57例(31.0%)、浮動性めまい20例(10.9%)、頭痛18例(9.8%)、傾眠17例(9.2%)及び不眠症13例(7.1%)、本剤20mg群で悪心77例(31.0%)、浮動性めまい49例(19.8%)、傾眠38例(15.3%)、嘔吐27例(10.9%)及び倦怠感22例(8.9%)であった。
17.1.2 国内長期投与試験
国内第III相試験の完了例403例を対象に実施した継続長期投与試験において、本剤20mgを心理社会的治療(BRENDA法12))と併用して24週間頓用した結果、安定した飲酒量低減の効果が維持された(図17-2)14)。
図17-2 多量飲酒日数のベースラインからの変化量の推移(国内第III相試験及び国内長期投与試験の治療期)
MMRM解析により算出した最小二乗平均±標準誤差
HDD数:多量飲酒日数
プラセボ→20mg:国内第III相試験(24週まで)でプラセボが投与され、国内長期投与試験の治療期で本剤20mgが投与された被験者
10mg又は20mg→20mg:国内第III相試験(24週まで)で本剤10mg又は20mgが投与され、国内長期投与試験の治療期で本剤20mgが投与された被験者
治療期の副作用発現頻度は、403例中211例(52.4%)であった。主な副作用は、悪心75例(18.6%)、浮動性めまい36例(8.9%)、頭痛24例(6.0%)、傾眠23例(5.7%)及び腹部不快感21例(5.2%)であった。
18. 薬効薬理
18.1 作用機序
ナルメフェンはμオピオイド受容体及びδオピオイド受容体に対しては拮抗薬として、κオピオイド受容体に対しては部分的作動薬として作用する15)16)ことにより飲酒量の低減作用を発揮すると考えられているが、明確な機序は不明である。
18.2 エタノール摂取量に対する効果
ナルメフェンは、エタノール自発摂取モデルのラットにおいて、エタノール摂取量を減少させた17)。
19. 有効成分に関する理化学的知見
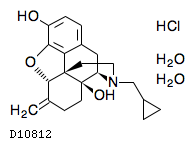
19.1. ナルメフェン塩酸塩水和物
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 本剤の安全性及び有効性を十分に理解し、アルコール依存症治療を適切に実施することができる医師によってのみ本剤が処方されるよう、適切な措置を講じること。
22. 包装
PTP
40錠(10錠×4)、100錠(10錠×10)
23. 主要文献
- 社内資料:毒性試験(2019年1月8日承認、CTD2.6.6)
- 社内資料:ラットにおける乳汁排泄(2019年1月8日承認、CTD2.6.4.6)
- 社内資料:健康成人における薬物動態(10mg)(2019年1月8日承認、CTD2.7.6.3)
- 社内資料:健康成人における薬物動態・食事の影響(2019年1月8日承認、CTD2.7.6.3)
- 社内資料:たん白結合の検討(2019年1月8日承認、CTD2.6.4.4)
- 社内資料:ヒト推定代謝経路(2019年1月8日承認、CTD2.7.2.2)
- 社内資料:マスバランス試験(2019年1月8日承認、CTD2.7.6.3)
- 社内資料:腎障害患者における薬物動態(2019年1月8日承認、CTD2.7.6.3)
- 社内資料:肝障害患者における薬物動態(2019年1月8日承認、CTD2.7.6.3)
- 社内資料:母集団薬物動態解析(2019年1月8日承認、CTD2.7.2.3)
- 社内資料:エタノールとの相互作用(2019年1月8日承認、CTD2.7.6.3)
- Starosta,A.N.et al., J Psychiatr Pract., 12 (2), 80-89, (2006) »PubMed
- 社内資料:アルコール依存症患者を対象とした国内二重盲検比較試験(2019年1月8日承認、CTD2.7.6.5)
- 社内資料:アルコール依存症患者を対象とした国内二重盲検比較試験の継続長期投与試験(2019年1月8日承認、CTD2.7.6.5)
- 社内資料:In vitro受容体親和性及び機能性評価試験(2019年1月8日承認、CTD2.6.2.2)
- 社内資料:In vivo機能性評価試験(2019年1月8日承認、CTD2.6.2.2)
- 社内資料:エタノール自発摂取モデルラットにおける作用(2019年1月8日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
大塚製薬株式会社 医薬情報センター
〒108-8242 東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
製品情報問い合わせ先
大塚製薬株式会社 医薬情報センター
〒108-8242 東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
26. 製造販売業者等
26.1 製造販売元
大塚製薬株式会社
東京都千代田区神田司町2-9
26.2 提携
ルンドベック・ジャパン株式会社
東京都港区虎ノ門四丁目1番17号 神谷町プライムプレイス
填写下方邮箱进行订阅,即可获取详细说明书,另有机会获得全处方辅料含量及部分COA等!
更多信息
你必须登录或注册一个新账户,以便接触產品
有用的信息
- 仅对制药厂、医药研发公司、医药研究所、医院服务,不对个人开放!

 请用手机扫二维码
请用手机扫二维码












必须要注册或登陆才可以发表评论
我们提供全球参比制剂,有需要可以评论留言
登录 注册