医薬品情報
| 総称名 | ヴァンフリタ |
|---|---|
| 一般名 | キザルチニブ塩酸塩 |
| 欧文一般名 | Quizartinib Hydrochloride |
| 製剤名 | キザルチニブ塩酸塩錠 |
| 薬効分類名 | 抗悪性腫瘍剤 FLT3阻害剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L01EX11 |
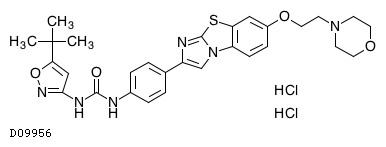
| KEGG DRUG | D09956 キザルチニブ塩酸塩 |
| JAPIC | 添付文書(PDF) |
添付文書情報2020年7月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ヴァンフリタ錠17.7mg | VANFLYTA TABLETS | 第一三共 | 4291060F1021 | 20059.6円/錠 | 劇薬, 処方箋医薬品注) |
| ヴァンフリタ錠26.5mg | VANFLYTA TABLETS | 第一三共 | 4291060F2028 | 27074.4円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
本剤の投与は、緊急時に十分対応できる医療施設において、造血器悪性腫瘍の治療に対して十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される患者についてのみ実施すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分に説明し、同意を得てから投与を開始すること。
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
再発又は難治性のFLT3-ITD変異陽性の急性骨髄性白血病
5. 効能または効果に関連する注意
十分な経験を有する病理医又は検査施設における検査により、FLT3-ITD変異陽性が確認された患者に投与すること。検査にあたっては、承認された体外診断薬を用いること。
FLT3-ITD変異:FMS様チロシンキナーゼ3-内部縦列重複変異
6. 用法及び用量
通常、成人にはキザルチニブとして1日1回26.5mgを2週間経口投与し、それ以降は1日1回53mgを経口投与する。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意
7.1 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.2 投与開始前に心電図検査を実施し、QTcF値が450msecを超えている場合には、本剤の投与を開始しないこと。また、本剤の投与開始から2週間後までにおいて、QTcF値が450msecを超えた場合には、本剤の増量は行わないこと。[8.1参照]
7.4 本剤投与中に副作用がみられた場合は、次の基準を参考に、本剤を休薬、減量又は中止すること。[7.3、8.1、8.2、9.1.1-9.1.3参照]
| 段階 | 用量 |
| 通常投与量 | 53mg |
| 1段階減量 | 26.5mg |
| 2段階減量 | 17.7mg |
| 副作用 | 基準 | 処置 |
| QT間隔延長 | 480msecを超え、500msec以下の延長 | 53mg又は26.5mgを投与していた場合は、1段階減量する。QTcF値が450msec以下に回復後は、副作用発現時の用量で再開できる。 17.7mgを投与していた場合は、休薬する。2週間の休薬後もQTcF値が450msec以下に回復しない場合は、投与を中止する。 |
| 500msecを超える延長 | 休薬する。QTcF値が450msec以下に回復後は、1段階減量して投与を再開できる。なお、17.7mgを投与していた場合は、回復後に同用量で再開できる。 2週間の休薬後もQTcF値が450msec以下に回復しない場合は、投与を中止する。 | |
| 生命を脅かす不整脈の症状/兆候を伴うQT間隔延長 | 投与を中止する。 | |
| 非血液系の副作用 (QT間隔延長を除く) | グレード3以上 | 休薬する。グレード1以下に回復後は、1段階減量して投与を再開できる。 グレード2以上の副作用が2週間を超えて継続する場合は、投与を中止する。 |
| 骨髄抑制 | 血小板数:100,000/mm3未満 かつ 好中球数:1,000/mm3未満 | 1段階減量又は休薬する。回復後は、副作用発現時の用量で再開できる。 2週間を超えて継続する場合は、投与を中止する。 |
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 QT間隔延長のある患者
9.1.2 不整脈につながる心疾患又はその既往のある患者
9.1.3 電解質異常(低カリウム血症、低マグネシウム血症等)のある患者
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者
9.4 生殖能を有する者
9.4.1 妊娠可能な女性
本剤投与中及び最終投与後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.4.2 パートナーが妊娠する可能性のある男性
本剤投与中及び最終投与後一定期間は適切な避妊を行うよう指導すること。[15.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。生殖発生毒性試験(ラット)において、臨床曝露量の約3倍の曝露に相当する用量で胎児毒性及び催奇形性が報告されている1)。[9.4.1参照]
9.6 授乳婦
授乳しないことが望ましい。本剤が乳汁に移行する可能性があり、乳児が乳汁を介して本剤を摂取した場合、乳児に重篤な副作用が発現するおそれがある。[15.2参照]
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
本剤は主にCYP3Aにより代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A
10.2 併用注意
| 本剤の副作用の発現が増強されるおそれがあるので、本剤を減量するとともに、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | これらの薬剤等がCYP3Aを阻害することにより、本剤の血中濃度が上昇する可能性がある。 | |
[16.7.2参照] | 本剤の効果が減弱するおそれがあるので、CYP3A誘導作用のない薬剤への代替を考慮すること。 | これらの薬剤等がCYP3Aを誘導することにより、本剤の血中濃度が低下する可能性がある。 |
QT間隔延長を起こすことが知られている薬剤 | QT間隔延長を増強するおそれがあるため、患者の状態を十分に観察すること。 | 本剤はIKs阻害作用を有しており、本剤及びこれらの薬剤はいずれもQT間隔を延長させるおそれがあるため、併用により副作用が増強するおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合は本剤の休薬、減量、投与中止等の適切な処置を行うこと。
11.1.1 QT間隔延長(26.3%)、心室性不整脈(Torsade de Pointesを含む)(頻度不明)[8.1参照]
11.1.2 感染症
敗血症及び敗血症ショック(5.0%)、肺炎(2.9%)、蜂巣炎(1.8%)、上気道感染(1.4%)、尿路感染(1.1%)等があらわれることがある。
11.1.3 出血
頭蓋内出血(0.7%)等があらわれることがある。[8.2参照]
11.1.4 骨髄抑制
血小板減少症(34.2%)、好中球減少症(25.9%)、貧血(25.9%)、白血球減少症(18.0%)、発熱性好中球減少症(15.8%)、リンパ球減少症(4.0%)、汎血球減少症(2.5%)等があらわれることがある。[8.2参照]
11.1.5 心筋梗塞(0.4%)
11.1.6 急性腎障害(1.4%)
11.1.7 間質性肺疾患
肺臓炎(0.7%)等があらわれることがある。間質性肺疾患が疑われた場合には、本剤の投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.2 その他の副作用
| 10%以上 | 5〜10%未満 | 5%未満 | |
| 皮膚 | 発疹 | 急性熱性好中球性皮膚症、点状出血 | |
| 精神神経系 | 味覚異常 | ||
| 消化器 | 悪心(31.7%)、嘔吐(18.3%)、下痢(11.5%) | 腹痛、口内炎 | 消化不良 |
| 肝臓 | ALT増加、血中ビリルビン増加、AST増加 | 血中ALP増加 | |
| その他 | 無力症 | 食欲減退、低カリウム血症、発熱、末梢性浮腫 | 低マグネシウム血症、体重減少、鼻出血 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 再発又は難治性の急性骨髄性白血病患者を対象とした海外第II相試験において、本剤投与後に白血病細胞の分化が認められたとの報告がある2)。
15.1.2 未治療のFLT3-ITD変異陽性の急性骨髄性白血病患者を対象とした化学療法注)との併用による国際共同試験において、外国人患者で、心室細動、心停止及び突然死が発現したとの報告がある。
注)寛解導入療法としてシタラビン+ダウノルビシン又はシタラビン+イダルビシン、地固め療法として高用量シタラビン
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回及び反復投与
日本人の再発又は難治性の急性骨髄性白血病患者に本剤17.7mg、26.5mg又は53mgを1日1回反復経口投与したとき、投与1日目及び15日目のキザルチニブの血漿中濃度推移並びにキザルチニブ及び活性代謝物(AC886)の薬物動態パラメータは次に示すとおりであった4)。キザルチニブの血漿中濃度は、反復投与15日目までに定常状態に達した。
また、再発又は難治性の急性骨髄性白血病患者に本剤53mgを1日1回反復経口投与したとき、母集団薬物動態解析より推定されたAUC0-24hの累積係数から算出された半減期はキザルチニブで73時間、AC886で119時間であった5)(外国人データ)。
また、再発又は難治性の急性骨髄性白血病患者に本剤53mgを1日1回反復経口投与したとき、母集団薬物動態解析より推定されたAUC0-24hの累積係数から算出された半減期はキザルチニブで73時間、AC886で119時間であった5)(外国人データ)。
日本人患者に本剤を反復投与したときのキザルチニブの血漿中濃度(1日目)
日本人患者に本剤を反復投与したときのキザルチニブの血漿中濃度(15日目)
| 投与量 (例数) | キザルチニブ | AC886 | |||||
| Cmax(ng/mL) | Tmax注)(h) | AUC0-24h(ng・h/mL) | Cmax(ng/mL) | Tmax注)(h) | AUC0-24h(ng・h/mL) | ||
| 1日目 | 17.7mg (n=9) | 42.8 (70.9) | 2.15 (1.95〜6.05) | 550 (99.3) | 24.6 (58.5) | 18.1 (3.95〜23.9) | 451 (55.3) |
| 26.5mg (n=3) | 73.4 (65.5) | 2.00 (2.00〜6.02) | 1,070 (54.9) | 28.9 (95.8) | 5.97 (5.97〜6.02) | 547 (92.8) | |
| 53mg (n=4) | 62.6 (49.6) | 4.04 (4.00〜6.03) | 1,060 (49.2) | 30.1 (116.4) | 14.9 (5.92〜23.8) | 534 (119.0) | |
| 15日目 | 17.7mg (n=8) | 81.5 (65.3) | 4.03 (2.08〜6.12) | 1,280 (63.1) | 132 (41.4) | 6.05 (0.57〜6.12) | 2,650 (41.3) |
| 26.5mg (n=3) | 148 (37.7) | 4.00 (2.07〜4.03) | 2,010 (66.2) | 160 (67.3) | 6.03 (4.00〜6.15) | 3,160 (62.6) | |
| 53mg (n=3) | 283 (20.4) | 6.08 (3.97〜6.12) | 5,080 (29.3) | 231 (23.4) | 6.12 (6.03〜23.7) | 4,930 (19.9) | |
16.2 吸収
16.2.1 食事の影響
健康被験者29例に本剤26.5mgを食後に単回経口投与したとき、空腹時(34例)に比べてキザルチニブのCmaxが8%低下し、AUCinfが8%上昇した6)(外国人データ)。
16.3 分布
キザルチニブ及びAC886のヒト血漿蛋白結合率はいずれも99%以上であり、キザルチニブは主にヒト血清アルブミンに結合した7)(in vitro)。また、キザルチニブ及びAC886の血液/血漿中濃度比はそれぞれ1.3〜1.5及び2.8〜3.4であった8)(in vitro)。
16.4 代謝
健康被験者6例に14Cで標識したキザルチニブ53mgを単回経口投与したとき、血漿中の主な代謝物はAC886(キザルチニブの水酸化体)であった9)(外国人データ)。キザルチニブは主にCYP3Aで代謝されること、AC886はキザルチニブからCYP3Aにより生成し、さらに主にCYP3Aで代謝されることが示された10)(in vitro)。なお、AC886はキザルチニブと同様の薬理活性を有する。[9.3.1、10.参照]
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 肝機能障害を有する被験者における薬物動態
本剤26.5mgを単回経口投与したとき、肝機能正常被験者(8例)と比べて、軽度の肝機能障害被験者(Child-Pugh分類A、8例)では、キザルチニブ及びAC886のAUCinfはそれぞれ30%及び20%増加した。中等度の肝機能障害被験者(Child-Pugh分類B、8例)では、キザルチニブのAUCinfは15%増加し、AC886のAUCinfは35%低下した。キザルチニブ及びAC886の血漿蛋白結合率は肝機能障害の影響を受けなかった11)(外国人データ)。
16.7 薬物相互作用
16.7.1 ケトコナゾール
健康被験者29例に、本剤26.5mgの単回投与をケトコナゾール(経口剤:国内未承認、200mg、1日2回28日間投与)と併用投与したとき、本剤単独投与群(29例)に比べてキザルチニブのCmax及びAUCinfはそれぞれ17%及び94%上昇し、AC886のCmax及びAUCinfはそれぞれ60%及び15%低下した12)(外国人データ)。[10.2参照]
16.7.2 リファンピシン
生理学的薬物動態モデルによるシミュレーションから、本剤53mgをリファンピシン(600mg、1日1回20日間投与)と併用投与した場合は、キザルチニブ及びAC886のAUCinfがそれぞれ72%及び66%低下すると推定された。[10.2参照]
16.7.3 その他の薬剤
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
再発又は難治性のFLT3-ITD変異陽性注1)の急性骨髄性白血病患者を対象に非盲検非対照試験を実施した16)。被験者37例に、本剤を1日1回経口投与した。開始用量をキザルチニブとして26.5mgとし、投与開始2週間後にQTcF値が450msec以下の場合、以降は53mgを投与した注2)。主要評価項目である治験責任医師判定による複合完全寛解率注3)は53.8%(14/26例)であった。主な副作用は、血小板数減少37.8%(14/37例)、心電図QT延長35.1%(13/37例)、発熱性好中球減少症32.4%(12/37例)、貧血27.0%(10/37例)であった。
注1)中央測定機関のPCR法で測定
注2)強いCYP3A阻害剤を併用する際には開始用量をキザルチニブとして17.7mgとし、投与開始2週間後にQTcF値が450msec以下の場合、以降は26.5mgを投与
注3)複合完全寛解率は以下に示すCR、CRp又はCRiのいずれかを達成した患者の割合
CR:骨髄の正常造血細胞が再生し、形態学的に白血病細胞が認められず、骨髄中の芽球数が5%未満、好中球絶対数が1.0×109/L以上、かつ血小板数が100×109/L以上であり、赤血球及び血小板輸血を行っておらず、髄外性白血病が認められていない状態
CRp:血小板数が100×109/L未満であることを除き、すべてのCRの条件を満たす状態
CRi:好中球絶対数が1.0×109/L未満であることを除き、すべてのCRの条件を満たす状態(ただし、血小板数の回復、赤血球及び血小板輸血の有無は問わない)、並びに赤血球又は血小板輸血を行っているが、その他すべてのCR又はCRpの条件を満たす状態
17.1.2 海外第III相試験
再発又は難治性のFLT3-ITD変異陽性注4)の急性骨髄性白血病患者を対象に無作為化非盲検群間比較試験を実施した17)。被験者367例を2:1の割合で本剤群又は救援療法群注5)に無作為に割り付け(本剤群245例、救援療法群122例)、本剤群には本剤を1日1回経口投与した。開始用量を26.5mgとし、投与開始2週間後にQTcF値が450msec以下の場合、以降は53mgを投与した注6)。主要評価項目である全生存期間の救援療法群に対する本剤群のハザード比[95%信頼区間]は、0.76[0.58,0.98]、中央値[95%信頼区間]は、本剤群で6.2[5.3,7.2]ヵ月、救援療法群で4.7[4.0,5.5]ヵ月であり、救援療法群と比較して本剤群で統計学的に有意な延長が認められた。また、本剤群における主な副作用は、悪心33.2%(80/241例)、心電図QT延長24.9%(60/241例)、貧血24.9%(60/241例)、血小板減少症21.2%(51/241例)であった18)。
注4)中央測定機関のPCR法で測定
注5)ミトキサントロン+エトポシド+シタラビン(MEC)、フルダラビン+シタラビン+G-CSF+イダルビシン(FLAG-IDA)、又は低用量シタラビン(LoDAC)のうちいずれか1種類を投与
注6)強いCYP3A阻害剤を併用する際には開始用量をキザルチニブとして17.7mgとし、投与開始2週間後にQTcF値が450msec以下の場合、以降は26.5mgを投与
全生存期間のKaplan-Meier曲線
17.3 その他
17.3.1 薬物濃度とQT間隔の関連性
国内第II相試験と海外第III相試験の併合解析により、本剤を1日1回反復投与した263例の急性骨髄性白血病患者において本剤がQT間隔に及ぼす影響を評価した。血漿中キザルチニブ及びAC886濃度とQTcF間隔との関係をシグモイドEmaxモデルで解析したところ、本剤投与28日目に53mgを投与された131例の患者でQTcFのベースライン値からの延長(ΔQTcF)は中央値が19.9msec、90%信頼区間の上限が22.0msecと推定された19)。
18. 薬効薬理
18.1 作用機序
キザルチニブは、受容体型チロシンキナーゼであるFLT3に対する阻害作用を有する低分子化合物である。キザルチニブは、ITD変異を有するFLT3に結合し、FLT3を介したシグナル伝達を阻害することにより、FLT3-ITD変異を有する腫瘍の増殖を抑制すると考えられている20)。
18.2 抗腫瘍効果
キザルチニブは、FLT3-ITD変異を有するヒト急性骨髄性白血病由来MV4-11細胞株を皮下移植したヌードマウスにおいて、腫瘍増殖抑制作用を示した21)。
19. 有効成分に関する理化学的知見
19.1. キザルチニブ塩酸塩
20. 取扱い上の注意
本剤は吸湿性を有するので、PTPシートからの取り出し後は速やかに服用すること。
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
<ヴァンフリタ錠17.7mg>
(PTP)10錠(10錠×1)
<ヴァンフリタ錠26.5mg>
(PTP)10錠(10錠×1)
23. 主要文献
- 社内資料:ラット胚・胎児発生毒性試験(2019年6月18日承認、CTD2.6.6.6)
- Nybakken GE,et al., Leukemia., 30 (6), 1422-1425, (2016) »PubMed
- 社内資料:細菌を用いた復帰突然変異試験(2019年6月18日承認、CTD2.6.6.4)
- 社内資料:再発・難治性急性骨髄性白血病患者を対象とした国内第I相試験(2019年6月18日承認、CTD2.7.6.5)
- 社内資料:母集団薬物動態解析(2019年6月18日承認、CTD2.7.2.2)
- 社内資料:食事の影響試験(2019年6月18日承認、CTD2.7.6.2)
- 社内資料:ヒト血漿蛋白結合率試験(2019年6月18日承認、CTD2.6.4.4)
- 社内資料:ヒト血液/血漿中濃度比試験(2019年6月18日承認、CTD2.6.4.4)
- 社内資料:外国人におけるマスバランス試験(2019年6月18日承認、CTD2.7.6.4)
- 社内資料:CYP分子種同定試験(2019年6月18日承認、CTD2.6.4.5)
- 社内資料:軽度及び中等度肝機能障害者を対象とした薬物動態試験(2019年6月18日承認、CTD2.7.6.7)
- 社内資料:CYP3A阻害剤との薬物相互作用試験(2019年6月18日承認、CTD2.7.6.8)
- 社内資料:ランソプラゾールとの薬物相互作用試験(2019年6月18日承認、CTD2.7.6.9)
- 社内資料:トランスポーターを介した輸送評価試験(2019年6月18日承認、CTD2.6.4.3)
- 社内資料:BCRPを介した輸送評価試験
- 社内資料:FLT3-ITD変異陽性の再発・難治性急性骨髄性白血病患者を対象とした国内第II相試験(2019年6月18日承認、CTD2.7.6.13)
- Cortes JE,et al., Lancet Oncol., 20 (7), 984-997, (2019) »PubMed
- 社内資料:FLT3-ITD変異陽性の再発・難治性急性骨髄性白血病患者を対象とした海外第III相試験(2019年6月18日承認、CTD2.7.6.12)
- 社内資料:血漿中濃度とQT間隔との関連性(2019年6月18日承認、CTD2.7.2.2)
- Zarrinkar PP,et al., Blood., 114 (14), 2984-2992, (2009) »PubMed
- 社内資料:FLT3-ITD変異を有するAML細胞株に対する抗腫瘍作用(2019年6月18日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
第一三共株式会社 製品情報センター
〒103-8426 東京都中央区日本橋本町3-5-1
電話:0120-065-132(がん・医療用麻薬専用)
製品情報問い合わせ先
第一三共株式会社 製品情報センター
〒103-8426 東京都中央区日本橋本町3-5-1
電話:0120-065-132(がん・医療用麻薬専用)
26. 製造販売業者等
26.1 製造販売元
第一三共株式会社
東京都中央区日本橋本町3-5-1
填写下方邮箱进行订阅,即可获取详细说明书,另有机会获得全处方辅料含量及部分COA等!
更多信息
你必须登录或注册一个新账户,以便接触產品
有用的信息
- 仅对制药厂、医药研发公司、医药研究所、医院服务,不对个人开放!

 请用手机扫二维码
请用手机扫二维码












必须要注册或登陆才可以发表评论
我们提供全球参比制剂,有需要可以评论留言
登录 注册