医薬品情報
| 総称名 | トリンテリックス |
|---|---|
| 一般名 | ボルチオキセチン臭化水素酸塩 |
| 欧文一般名 | Vortioxetine Hydrobromide |
| 製剤名 | ボルチオキセチン臭化水素酸塩錠 |
| 薬効分類名 | セロトニン再取り込み阻害・セロトニン受容体調節剤 |
| 薬効分類番号 | 1179 |
| ATCコード | N06AX26 |
| KEGG DRUG | D10185 ボルチオキセチン臭化水素酸塩 |
| JAPIC | 添付文書(PDF) |
添付文書情報2021年12月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| トリンテリックス錠10mg | Trintellix Tablets 10mg | 武田薬品工業 | 1179060F1028 | 161.7円/錠 | 劇薬, 処方箋医薬品注) |
| トリンテリックス錠20mg | Trintellix Tablets 20mg | 武田薬品工業 | 1179060F2024 | 242.5円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
5.1 抗うつ剤の投与により、24歳以下の患者で、自殺念慮、自殺企図のリスクが増加するとの報告があるため、本剤の投与にあたっては、リスクとベネフィットを考慮すること。[8.1-8.4、9.1.2、9.1.3、15.1.1参照]
5.2 本剤を18歳未満の大うつ病性障害患者に投与する際には適応を慎重に検討すること。[9.7.2、9.7.3参照]
6. 用法及び用量
通常、成人にはボルチオキセチンとして10mgを1日1回経口投与する。なお、患者の状態により1日20mgを超えない範囲で適宜増減するが、増量は1週間以上の間隔をあけて行うこと。
7. 用法及び用量に関連する注意
7.1 本剤の投与量は必要最小限となるよう、患者ごとに慎重に観察しながら調節すること。
8. 重要な基本的注意
8.1 うつ症状を呈する患者は希死念慮があり、自殺企図のおそれがあるので、このような患者は投与開始早期ならびに投与量を変更する際には、患者の状態及び病態の変化を注意深く観察すること。[5.1、8.2-8.4、9.1.2、9.1.3、15.1.1参照]
8.2 不安、焦燥、興奮、パニック発作、不眠、易刺激性、敵意、攻撃性、衝動性、アカシジア/精神運動不穏、軽躁、躁病等があらわれることが報告されている。また、因果関係は明らかではないが、これらの症状・行動を来した症例において、基礎疾患の悪化又は自殺念慮、自殺企図、他害行為が報告されている。患者の状態及び病態の変化を注意深く観察するとともに、これらの症状の増悪が観察された場合には、服薬量を増量せず、徐々に減量し、中止するなど適切な処置を行うこと。[5.1、8.1、8.3、8.4、9.1.2-9.1.5、15.1.1参照]
8.3 自殺目的での過量服用を防ぐため、自殺傾向が認められる患者に処方する場合には、1回分の処方日数を最小限にとどめること。[5.1、8.1、8.2、8.4、9.1.2、9.1.3、15.1.1参照]
8.4 家族等に自殺念慮や自殺企図、興奮、攻撃性、易刺激性等の行動の変化及び基礎疾患の悪化があらわれるリスク等について十分説明を行い、医師と緊密に連絡を取り合うよう指導すること。[5.1、8.1-8.3、9.1.2-9.1.5、15.1.1参照]
8.5 投与中止(突然の中止)により、不安、焦燥、興奮、浮動性めまい、錯感覚、頭痛及び悪心等があらわれることが報告されている。投与を中止する際には患者の状態を観察しながら慎重に行うこと。
8.6 眠気、めまい等があらわれることがあるので、自動車の運転等危険を伴う機械を操作する際には十分注意させること。また、これらの症状を自覚した場合には、自動車の運転等危険を伴う機械の操作に従事しないよう患者に指導すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.2 自殺念慮又は自殺企図の既往のある患者、自殺念慮のある患者
9.1.3 双極性障害患者
9.1.4 脳の器質的障害又は統合失調症の素因のある患者
9.1.5 衝動性が高い併存障害を有する患者
9.1.6 てんかん等の痙攣性疾患又はこれらの既往歴のある患者
痙攣があらわれるおそれがある。[11.1.2参照]
9.1.7 出血傾向又は出血性素因のある患者
出血傾向が増強することがある。[11.2参照]
9.1.8 緑内障又は眼内圧亢進の患者
症状を悪化させるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.5.1 ラット及びウサギの胚・胎児発生毒性試験において、催奇形作用及び胎児生存率への影響は認められなかった。なお、母動物に毒性がみられる用量〔ラット及びウサギにおいて、最大臨床用量(20mg/日)におけるボルチオキセチンの曝露量(AUC)のそれぞれ30倍以上及び1倍未満の曝露量〕において、胎児体重の減少及び骨化の遅延が認められている。また、ラットを用いた出生前及び出生後の発生並びに母体の機能に関する試験では、最大臨床用量(20mg/日)におけるボルチオキセチンの曝露量(Cmax)の8.4倍以上の曝露量で出生児の体重増加不良、発達遅延及び死亡率の増加が認められている。
9.5.2 妊娠末期に選択的セロトニン再取り込み阻害剤(SSRI)又はセロトニン・ノルアドレナリン再取り込み阻害剤(SNRI)を投与された女性が出産した新生児において、入院期間の延長、呼吸補助、経管栄養を必要とする、離脱症状と同様の症状が出産直後にあらわれたとの報告がある。
9.5.3 海外の疫学調査において、妊娠中にSSRIを投与された女性が出産した新生児において、新生児遷延性肺高血圧症のリスクが増加したとの報告がある。このうち1つの調査では、妊娠34週以降に生まれた新生児における新生児遷延性肺高血圧症発生のリスク比は、妊娠早期の投与では2.4(95%信頼区間1.2-4.3)、妊娠早期及び後期の投与では3.6(95%信頼区間1.2-8.3)であった。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ラットで乳汁中へ移行することが報告されている。
9.7 小児等
9.7.1 小児等を対象とした国内臨床試験は実施していない。
9.7.2 海外で実施された18歳以下の大うつ病性障害(DSM注)-IVにおける分類)患者を対象とした、SSRI、SNRI及びノルアドレナリン・セロトニン作動性抗うつ剤(NaSSA)のプラセボ対照の臨床試験において有効性が確認できなかったとの報告がある。[5.2参照]
9.7.3 海外で実施された12〜17歳の大うつ病性障害(DSM注)-Vにおける分類)患者を対象とした、本剤のプラセボ対照臨床試験において有効性が確認できなかったとの報告がある。[5.2参照]
9.8 高齢者
慎重に投与すること。一般に高齢者では生理機能が低下していることが多く、また、低ナトリウム血症、抗利尿ホルモン不適合分泌症候群(SIADH)の危険性が高くなることがある。[11.1.3参照]
注)DSM:American Psychiatric Association(米国精神医学会)のDiagnostic and Statistical Manual of Mental Disorders.(精神疾患の診断・統計マニュアル)
10. 相互作用
相互作用序文
本剤は肝薬物代謝酵素CYP2D6、CYP3A4/5、CYP2C19、CYP2C9、CYP2A6、CYP2C8及びCYP2B6で代謝される。
薬物代謝酵素用語
CYP2D6
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP3A5
薬物代謝酵素用語
CYP2C19
薬物代謝酵素用語
CYP2C9
薬物代謝酵素用語
CYP2A6
薬物代謝酵素用語
CYP2C8
薬物代謝酵素用語
CYP2B6
10.1 併用禁忌
エフピー アジレクト エクフィナ | セロトニン症候群があらわれることがあるので、左記薬剤を投与中又は投与中止後14日間以内の患者には投与しないこと。また、本剤投与後に左記薬剤を投与する際には14日間以上の間隔をあけること。 | セロトニンの分解が阻害され、脳内セロトニン濃度が高まると考えられる。 |
10.2 併用注意
[11.1.1参照] | セロトニン症候群等のセロトニン作用による症状があらわれるおそれがあるので、観察を十分に行うこと。 | 左記薬剤のMAO阻害作用によりセロトニンの分解が阻害され、脳内セロトニン濃度が高まると考えられる。 |
セロトニン作用薬 [11.1.1参照] | セロトニン症候群等のセロトニン作用による症状があらわれるおそれがあるので、観察を十分に行うこと。 | 本剤はセロトニン再取り込み阻害作用を有するため、併用によりセロトニン作用が増強するおそれがある。 |
| 本剤の血中濃度が上昇し、副作用があらわれるおそれがある。 | 本剤の代謝が阻害されるおそれがある。 | |
| 本剤の血中濃度が低下し、作用が減弱するおそれがあるので、併用する場合は、患者の状態に応じて、本剤の用量を適宜調節すること。 | 本剤の代謝が促進されるおそれがある。 | |
出血傾向が増強する薬剤 | 出血傾向が増強するおそれがある。 | 本剤の投与により血小板凝集能が阻害されるおそれがある。 |
アルコール(飲酒) | 本剤投与中は飲酒を避けさせることが望ましい。 | 本剤との相互作用は認められていないが、他の抗うつ剤で作用の増強が報告されている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 セロトニン症候群(頻度不明)
不安、焦燥、興奮、錯乱、発汗、下痢、発熱、高血圧、固縮、頻脈、ミオクローヌス、自律神経不安定等があらわれることがあるので、異常が認められた場合には投与を中止し、体冷却、水分補給等の全身管理とともに適切な処置を行うこと。セロトニン作用薬との併用時には、特に注意すること。[2.2、10.1、10.2参照]
11.1.2 痙攣(頻度不明)[9.1.6参照]
11.1.3 抗利尿ホルモン不適合分泌症候群(SIADH)(頻度不明)
低ナトリウム血症、低浸透圧血症、尿中ナトリウム排泄量の増加、高張尿、痙攣、意識障害等を伴う抗利尿ホルモン不適合分泌症候群(SIADH)があらわれるおそれがあるので、異常が認められた場合には投与を中止し、水分摂取の制限等適切な処置を行うこと。高齢者、肝硬変を有する患者、SIADH、低ナトリウム血症を起こすことが知られている薬剤を投与中の患者等では特に注意すること。[9.8参照]
11.2 その他の副作用
| 10%以上 | 1〜10%未満 | 1%未満 | 頻度不明 | |
| 免疫 | アナフィラキシー反応 | |||
| 内分泌 | 高プロラクチン血症 | |||
| 精神神経系 | 傾眠、頭痛、めまい、不眠症 | 異常な夢、リビドー減退 | ||
| 消化器 | 悪心 | 下痢、便秘、嘔吐 | ||
| 血管 | 潮紅 | 出血(挫傷、斑状出血、鼻出血、胃腸出血、膣出血を含む)注) | ||
| 皮膚 | そう痒・全身性そう痒、じん麻疹・発疹 | 寝汗 | 血管浮腫、多汗症 | |
| その他 | 倦怠感 | 勃起不全、射精遅延 |
13. 過量投与
13.1 徴候・症状
海外の製造販売後において、過量投与後に痙攣、セロトニン症候群がみられたとの報告がある。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 海外で実施された大うつ病性障害等の精神疾患を有する患者を対象とした、複数の抗うつ剤(本剤は含まず)の短期プラセボ対照臨床試験の検討結果において、24歳以下の患者では、自殺念慮及び自殺企図の発現のリスクが抗うつ剤投与群でプラセボ群と比較して高かった。なお、25歳以上の患者における自殺念慮及び自殺企図の発現のリスクの上昇は認められず、65歳以上においてはそのリスクが減少した。[5.1、8.1-8.4、9.1.2、9.1.3参照]
15.1.2 主に50歳以上を対象に実施された海外の疫学調査において、SSRI及び三環系抗うつ剤を含む抗うつ剤を投与された患者で、骨折のリスクが上昇したとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性(18例)にボルチオキセチンとして10mgを空腹時に単回投与したときのボルチオキセチンの血漿中濃度推移及び薬物動態学的パラメータは以下のとおりであった1)。
血漿中濃度推移(平均値+標準偏差)
| 投与量 | Cmax(ng/mL) | Tmax(h) | AUC168(h・ng/mL) | T1/2(h) |
| 10mg | 3.923(0.70785) | 12.0(6-14) | 289.9(88.126) | 67.63(18.516) |
16.1.2 反復投与
健康成人男性(6例)に、ボルチオキセチンとして10mgを12日間投与したときのボルチオキセチンの血漿中濃度推移及び薬物動態学的パラメータは以下のとおりであった2)。
血漿中濃度推移(平均値+標準偏差)
| 投与量 | Cmax(ng/mL) | Tmax(h) | AUC24(h・ng/mL) | T1/2(h) |
| 10mg | 21.15(4.0451) | 8.0(6-12) | 431.7(76.023) | 65.06(13.276) |
16.2 吸収
16.2.1 バイオアベイラビリティ
健康成人(22例)にボルチオキセチンとして単回経口投与(20mg)及び静脈内投与(10mg)したときの絶対的バイオアベイラビリティは74.9%であった3)(外国人データ)。
16.2.2 食事の影響
健康成人男性(18例)にボルチオキセチンとして10mgを空腹時又は食後に投与したとき、Cmax及びAUCに統計学的有意差は認められず、食事の影響は認められなかった1)。
16.3 分布
ボルチオキセチンは血管外に広く分布する。in vitroでの血漿タンパク結合率は98.2〜99.3%であった4)。
健康成人データを用いた母集団薬物動態解析の結果、見かけの分布容積は約2600Lであった5)。
健康成人データを用いた母集団薬物動態解析の結果、見かけの分布容積は約2600Lであった5)。
16.4 代謝
主に酸化及びグルクロン酸抱合により広範な代謝を受ける。ボルチオキセチンの代謝には複数のCYP分子種(CYP2D6、CYP3A4/5、CYP2C19、CYP2C9、CYP2A6、CYP2C8及びCYP2B6)が関与する6)。ボルチオキセチンはP-糖蛋白質の基質である可能性は低く、P-糖蛋白質に対して弱い阻害作用を示す。[10.2参照]
健康成人データを用いた母集団薬物動態解析の結果、ボルチオキセチンの血漿中濃度は、CYP2D6遺伝子の表現型がExtensive Metabolizerの患者と比較して、Poor Metabolizerの患者で約2倍になることが想定された7)。[7.2、9.1.1、10.2参照]
健康成人データを用いた母集団薬物動態解析の結果、ボルチオキセチンの血漿中濃度は、CYP2D6遺伝子の表現型がExtensive Metabolizerの患者と比較して、Poor Metabolizerの患者で約2倍になることが想定された7)。[7.2、9.1.1、10.2参照]
16.5 排泄
未変化体はほぼ検出されず、代謝物は主に尿中及び糞便中に排泄された。健康成人男性(6例)にボルチオキセチンとして50mg注)を単回投与したとき、投与360時間後までに総放射能の約59%が尿中に、26%が糞便中に排泄された8)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
ボルチオキセチンとして10mgを投与したとき、軽度腎機能障害患者(Cockcroft-Gaultの式で求めたクレアチニンクリアランス51〜80mL/min)(8例)において、健康成人と比較しボルチオキセチンのAUCは9.13%高く、Cmaxは10.50%低かった。中等度腎機能障害患者(30〜50mL/min)(8例)において、健康成人と比較しボルチオキセチンのAUCは16.03%高かったが、Cmaxは同程度であった。高度腎機能障害患者(30mL/min未満)(9例)において、健康成人と比較しボルチオキセチンのAUC及びCmaxはそれぞれ10.52%及び8.18%高かった9)(外国人データ)。
16.6.2 肝機能障害患者
ボルチオキセチンとして10mgを投与したとき、軽度肝機能障害患者(Child-Pughによる重症度分類でClass A)(8例)において、健康成人と比較しボルチオキセチンのAUC及びCmaxはそれぞれ9.07%及び14.45%低かった。中等度肝機能障害患者(Class B)(8例)において、健康成人と比較しボルチオキセチンのAUC及びCmaxはそれぞれ1.93%及び16.12%低かった10)。ボルチオキセチンとして5mg注)を投与したとき、高度肝機能障害患者(Class C)(6例)において、健康成人と比較しボルチオキセチンのAUCは10%高く、Cmaxは24%低かった11)(外国人データ)。
16.6.3 高齢者
ボルチオキセチンとして10mgを投与したとき、ボルチオキセチンの曝露量は、高齢男性の方が成人男性に比べ約9%高かった12)。
16.7 薬物相互作用
16.7.1 CYP2D6阻害薬
健康成人(28例)にボルチオキセチンとして10mg1日1回とBupropion(本邦未承認薬)150mgを1日2回反復併用投与したとき、ボルチオキセチンのAUC24及びCmaxは、単独投与時に比べそれぞれ2.3倍及び2.1倍に増加した13)(外国人データ)。[7.2、9.1.1、10.2、16.4参照]
16.7.2 肝薬物代謝酵素の誘導作用を有する薬剤
健康成人(14例)にリファンピシン600mg反復投与時にボルチオキセチンとして20mgを単回投与したとき、ボルチオキセチンの単独投与時に比べてAUCは77.20%低かった14)(外国人データ)。[10.2参照]
注)本剤の国内承認用量は、1日1回10mgであり、患者の状態により1日20mgを超えない範囲で適宜増減する。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相臨床試験(二重盲検比較試験)
大うつ病性障害患者を対象とした二重盲検比較試験において、投与8週時点におけるMADRS合計スコアのベースラインからの変化量(MMRM)は、プラセボ群と比較して本剤10mg群及び20mg群で統計学的に有意な低下がみられた15)。
| 投与群 | MADRS合計スコア(MMRM) | ||
| ベースラインからの変化量 | プラセボ群との最小二乗平均値の差 | ||
| 最小二乗平均値(標準誤差) | 点推定値(標準誤差) | p値 | |
| プラセボ群(n=161) | −12.37(0.714) | − | − |
| 本剤10mg群(n=165) | −15.03(0.699) | −2.66(0.999) | 0.0080 |
| 本剤20mg群(n=163) | −15.45(0.705) | −3.07(1.003) | 0.0023 |
副作用発現頻度は、本剤10mg群で35.2%(58/165例)、本剤20mg群で36.2%(59/163例)であり、主な副作用は、本剤10mg群で悪心12.1%(20/165例)、嘔吐5.5%(9/165例)、傾眠4.2%(7/165例)、下痢3.0%(5/165例)、頭痛3.0%(5/165例)、本剤20mg群で悪心15.3%(25/163例)、傾眠6.7%(11/163例)、便秘3.1%(5/163例)、腹部不快感3.1%(5/163例)であった15)。
17.1.2 国内第III相臨床試験(長期投与試験)
二重盲検比較試験終了後の大うつ病性障害患者を対象とした非盲検長期投与試験において、ボルチオキセチン10mgを2週間投与後、可変用量(5、10又は20mg)で50週間投与したときのMADRS合計スコアに基づき、抗うつ効果が維持された16)。
| 投与期間 | 例数 | ベースラインからの変化量 平均値(標準偏差) |
| 2週 | 119 | −0.6(5.11) |
| 4週 | 118 | −2.4(6.79) |
| 8週 | 116 | −4.6(6.85) |
| 12週 | 115 | −6.0(7.02) |
| 20週 | 111 | −6.5(7.32) |
| 28週 | 102 | −6.9(7.36) |
| 36週 | 95 | −7.4(8.32) |
| 44週 | 90 | −8.6(7.18) |
| 52週 | 88 | −9.9(6.62) |
| LOCF | 119 | −8.1(8.67) |
副作用発現頻度は、50.4%(60/119例)であり、主な副作用は、悪心16.8%(20/119例)、体重増加5.9%(7/119例)、下痢5.0%(6/119例)、傾眠5.0%(6/119例)であった16)。
18. 薬効薬理
18.1 作用機序
ボルチオキセチンはセロトニン再取り込み阻害作用並びにセロトニン受容体調節作用(セロトニン3受容体、セロトニン7受容体及びセロトニン1D受容体のアンタゴニスト作用、セロトニン1B受容体部分アゴニスト作用、セロトニン1A受容体アゴニスト作用)を有する。セロトニン再取り込み阻害作用(cIC50=5.4nmol/L)は、ノルアドレナリン再取り込み阻害作用(cIC50=107nmol/L)やドパミン再取り込み阻害作用(cIC50=1470nmol/L)と比較してより強力である。
18.2 抗うつ作用
19. 有効成分に関する理化学的知見
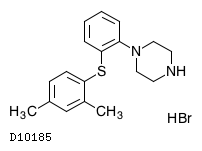
19.1. ボルチオキセチン臭化水素酸塩
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
PTP 100錠(10錠×10)
23. 主要文献
- ボルチオキセチンの薬物動態試験成績[1](2019年9月20日承認、CTD 2.7.6.1)
- ボルチオキセチンの薬物動態試験成績[2](2019年9月20日承認、CTD 2.7.6.5)
- ボルチオキセチンの吸収に関する検討(2019年9月20日承認、CTD 2.7.6.3)
- ボルチオキセチンの分布に関する検討[1](2019年9月20日承認、CTD 2.7.2.2)
- ボルチオキセチンの分布に関する検討[2](2019年9月20日承認、CTD 2.7.2.3)
- ボルチオキセチンの代謝に関する検討[1](2019年9月20日承認、CTD 2.7.2.2)
- ボルチオキセチンの代謝に関する検討[2](2019年9月20日承認、CTD 2.7.2.3)
- ボルチオキセチンの排泄に関する検討(2019年9月20日承認、CTD 2.7.6.8)
- ボルチオキセチンの腎機能障害患者における薬物動態試験成績(2019年9月20日承認、CTD 2.7.6.13)
- ボルチオキセチンの肝機能障害患者における薬物動態試験成績[1](2019年9月20日承認、CTD 2.7.6.11)
- ボルチオキセチンの肝機能障害患者における薬物動態試験成績[2](2019年9月20日承認、CTD 2.7.6.12)
- ボルチオキセチンの高齢者における薬物動態試験成績(2019年9月20日承認、CTD 2.7.2.3)
- ボルチオキセチンの薬物相互作用に関する検討[1](2019年9月20日承認、CTD 2.7.6.14)
- ボルチオキセチンの薬物相互作用に関する検討[2](2019年9月20日承認、CTD 2.7.6.15)
- ボルチオキセチンの臨床試験成績[1](2019年9月20日承認、CTD 2.7.6.32)
- ボルチオキセチンの臨床試験成績[2](2019年9月20日承認、CTD 2.7.6.46)
- ボルチオキセチンの抗うつ作用に関する検討(2019年9月20日承認、CTD 2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
武田薬品工業株式会社 くすり相談室
〒103-8668 東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
製品情報問い合わせ先
武田薬品工業株式会社 くすり相談室
〒103-8668 東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
武田薬品工業株式会社
〒540-8645 大阪市中央区道修町四丁目1番1号
26.2 提携
ルンドベック・ジャパン株式会社
東京都港区虎ノ門四丁目1番17号 神谷町プライムプレイス
填写下方邮箱进行订阅,即可获取详细说明书,另有机会获得全处方辅料含量及部分COA等!
更多信息
你必须登录或注册一个新账户,以便接触產品
有用的信息
- 仅对制药厂、医药研发公司、医药研究所、医院服务,不对个人开放!

 请用手机扫二维码
请用手机扫二维码












必须要注册或登陆才可以发表评论
我们提供全球参比制剂,有需要可以评论留言
登录 注册