| 総称名 | ビラフトビ |
|---|---|
| 一般名 | エンコラフェニブ |
| 欧文一般名 | Encorafenib |
| 製剤名 | エンコラフェニブカプセル |
| 薬効分類名 | −抗悪性腫瘍剤− BRAF阻害剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L01EC03 |
| KEGG DRUG | D11053 エンコラフェニブ |
| KEGG DGROUP | DG03159 BRAF阻害薬 |
| JAPIC | 添付文書(PDF) |
添付文書情報2022年12月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ビラフトビカプセル50mg | BRAFTOVI Capsules | 小野薬品工業 | 4291057M1029 | 3239.6円/カプセル | 劇薬, 処方箋医薬品注) |
| ビラフトビカプセル75mg | BRAFTOVI Capsules | 小野薬品工業 | 4291057M2025 | 4769.8円/カプセル | 劇薬, 処方箋医薬品注) |
1. 警告
本剤は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本剤の使用が適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
<効能共通>
5.1 十分な経験を有する病理医又は検査施設における検査により、BRAF遺伝子変異が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
5.2 「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
5.3 本剤の術後補助療法における有効性及び安全性は確立していない。
<がん化学療法後に増悪したBRAF遺伝子変異を有する治癒切除不能な進行・再発の結腸・直腸癌>
5.4 本剤の一次治療における有効性及び安全性は確立していない。
6. 用法及び用量
<BRAF遺伝子変異を有する根治切除不能な悪性黒色腫>
ビニメチニブとの併用において、通常、成人にはエンコラフェニブとして450mgを1日1回経口投与する。なお、患者の状態により適宜減量する。
<がん化学療法後に増悪したBRAF遺伝子変異を有する治癒切除不能な進行・再発の結腸・直腸癌>
セツキシマブ(遺伝子組換え)との併用、又はビニメチニブ及びセツキシマブ(遺伝子組換え)との併用において、通常、成人にはエンコラフェニブとして300mgを1日1回経口投与する。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意
<BRAF遺伝子変異を有する根治切除不能な悪性黒色腫>
7.1 本剤投与により副作用が発現した場合には、下記の基準を参考に、本剤を休薬、減量又は中止すること。
7.2 本剤単独投与時の忍容性を検討した臨床試験では、1日1回450mg投与は本剤の最大耐用量を上回る可能性が示唆されている。ビニメチニブを休薬又は中止した場合には、本剤の減量を考慮するとともに、患者の状態を慎重に観察し、副作用の発現に十分注意すること。[17.1.1参照]
| 減量レベル※1 | 投与量 |
| 通常投与量 | 450mg1日1回 |
| 1段階減量 | 300mg1日1回 |
| 2段階減量 | 200mg1日1回 |
| 3段階減量 | 投与中止 |
| 副作用 | 程度※2 | 処置 |
| 網膜疾患、ぶどう膜炎 | Grade 2 | Grade 1以下に回復するまで休薬。再開する場合、同量又は1段階減量して投与。 |
| Grade 3 | Grade 2以下に回復するまで休薬。再開する場合、1段階減量して投与。Grade 3が継続する場合、投与中止。 | |
| Grade 4 | 投与中止。 | |
| 網膜静脈閉塞 | Grade 1以上 | 投与中止。 |
| 眼障害(上記以外) | Grade 3 | Grade 1以下に回復するまで休薬。28日以内で回復し再開する場合、1段階減量して投与。28日以内で回復しない場合、投与中止。 |
| Grade 4 | 投与中止。 | |
| AST増加、ALT増加 | Grade 2(血清ビリルビン上昇を伴わない場合) | 14日を超えて継続する場合、Grade 1以下に回復するまで休薬。再開する場合、同量で投与。ただし、再発した場合、休薬し回復後に1段階減量して投与。 |
| Grade 2(血清ビリルビン上昇を伴う場合) | Grade 1以下に回復するまで休薬。7日以内で回復し再開する場合、1段階減量して投与。7日以内で回復しない場合、投与中止。 | |
| Grade 3(血清ビリルビン上昇を伴わない場合) | Grade 1以下に回復するまで休薬。14日以内で回復し再開する場合、同量で投与。14日超で回復し再開する場合、1段階減量して投与。 | |
| Grade 3(血清ビリルビン上昇を伴う場合)及びGrade 4 | 投与中止。 | |
| 血清CK上昇 | Grade 3-4(血清クレアチニン上昇を伴う場合) | Grade 1以下に回復するまで休薬。28日以内で回復し再開する場合、1段階減量して投与。28日以内で回復しない場合、投与中止。 |
| 心電図QT延長 | 500msを超えるQTc値が認められ、かつ投与前からの変化が60ms以下の場合 | QTc値が500msを下回るまで休薬。再開する場合、1段階減量して再開すること。ただし、再発した場合、投与中止。 |
| 500msを超えるQTc値が認められ、かつ投与前からの変化が60msを超える場合 | 投与中止。 | |
| 皮膚炎 | Grade 2 | 症状が継続又は悪化する場合、Grade 1以下に回復するまで休薬。再開する場合、同量で投与。 |
| Grade 3 | Grade 1以下に回復するまで休薬。再開する場合、同量で投与。ただし、再発した場合、休薬し回復後に1段階減量して投与。 | |
| Grade 4 | 投与中止。 | |
| 手掌・足底発赤知覚不全症候群 | Grade 2 | 14日を超えて継続する場合、Grade 1以下に回復するまで休薬。再開する場合、同量で投与。ただし、再発した場合、休薬し回復後に1段階減量して投与することを考慮。 |
| Grade 3 | Grade 1以下に回復するまで休薬。再開する場合、1段階減量して投与。ただし、再発を繰り返す場合、1段階減量して投与又は投与中止することも考慮。 | |
| 上記以外の副作用 | Grade 2 | Grade 2が継続する場合、休薬又は減量を考慮。 |
| Grade 3 | Grade 1以下に回復するまで休薬を考慮。28日以内で回復し再開する場合、1段階減量して投与することを考慮。 | |
| Grade 4 | 投与中止。 |
<がん化学療法後に増悪したBRAF遺伝子変異を有する治癒切除不能な進行・再発の結腸・直腸癌>
7.3 本剤投与により副作用が発現した場合には、下記の基準を参考に、本剤を休薬、減量又は中止すること。
7.4 ビニメチニブ及びセツキシマブ(遺伝子組換え)との併用において、ビニメチニブ及びセツキシマブ(遺伝子組換え)の両剤を休薬又は中止した場合には、本剤をそれぞれ休薬又は中止すること。
7.5 セツキシマブ(遺伝子組換え)との併用において、セツキシマブ(遺伝子組換え)を休薬又は中止した場合には、本剤をそれぞれ休薬又は中止すること。
7.6 併用する他の抗悪性腫瘍剤の選択に際しては、「17.臨床成績」の項の内容を熟知し、関連学会の最新のガイドライン等を参考にした上で、患者の状態に応じて、ビニメチニブの併用の必要性を判断すること。
| 減量レベル※3 | 投与量 |
| 通常投与量 | 300mg1日1回 |
| 1段階減量 | 225mg1日1回 |
| 2段階減量 | 150mg1日1回 |
| 3段階減量 | 投与中止 |
| 副作用 | 程度※4 | 処置 |
| 網膜疾患、ぶどう膜炎 | Grade 2 | Grade 1以下に回復するまで休薬。再開する場合、同量又は1段階減量して投与。 |
| Grade 3 | Grade 2以下に回復するまで休薬。再開する場合、1段階減量して投与。Grade 3が継続する場合、投与中止。 | |
| Grade 4 | 投与中止。 | |
| 網膜静脈閉塞 | Grade 1以上 | 投与中止。 |
| 眼障害(上記以外) | Grade 3 | Grade 1以下に回復するまで休薬。21日以内で回復し再開する場合、1段階減量して投与。21日以内で回復しない場合、投与中止。 |
| Grade 4 | 投与中止。 | |
| AST増加、ALT増加 | Grade 2(血清ビリルビン上昇を伴わない場合) | 14日を超えて継続する場合、Grade 1以下に回復するまで休薬。再開する場合、同量で投与。ただし、再発した場合、休薬し回復後に1段階減量して投与。 |
| Grade 2(血清ビリルビン上昇を伴う場合) | Grade 1以下に回復するまで休薬。7日以内で回復し再開する場合、1段階減量して投与。7日以内で回復しない場合、投与中止。 | |
| Grade 3(血清ビリルビン上昇を伴わない場合) | Grade 1以下に回復するまで休薬。14日以内で回復し再開する場合、同量で投与。14日超で回復し再開する場合、1段階減量して投与。 | |
| Grade 3(血清ビリルビン上昇を伴う場合)及びGrade 4 | 投与中止。 | |
| 血清CK上昇 | Grade 3-4(血清クレアチニン上昇を伴う場合) | Grade 1以下に回復するまで休薬。21日以内で回復し再開する場合、1段階減量して投与。21日以内で回復しない場合、投与中止。 |
| 心電図QT延長 | 500msを超えるQTc値が認められ、かつ投与前からの変化が60ms以下の場合 | QTc値が500msを下回るまで休薬。再開する場合、1段階減量して再開すること。ただし、再発した場合、投与中止。 |
| 500msを超えるQTc値が認められ、かつ投与前からの変化が60msを超える場合 | 投与中止。 | |
| 皮膚炎 | Grade 2 | 症状が継続又は悪化する場合、Grade 1以下に回復するまで休薬。再開する場合、同量で投与。 |
| Grade 3 | Grade 1以下に回復するまで休薬。再開する場合、同量で投与。ただし、再発した場合、休薬し回復後に1段階減量して投与。 | |
| Grade 4 | 投与中止。 | |
| 手掌・足底発赤知覚不全症候群 | Grade 2 | 14日を超えて継続する場合、Grade 1以下に回復するまで休薬。再開する場合、同量で投与。ただし、再発した場合、休薬し回復後に1段階減量して投与することを考慮。 |
| Grade 3 | Grade 1以下に回復するまで休薬。再開する場合、1段階減量して投与。ただし、再発を繰り返す場合、1段階減量して投与又は投与中止することも考慮。 | |
| 上記以外の副作用 | Grade 2 | Grade 2が継続する場合、休薬又は減量を考慮。 |
| Grade 3 | Grade 1以下に回復するまで休薬を考慮。21日以内で回復し再開する場合、1段階減量して投与することを考慮。 | |
| Grade 4 | 投与中止。 |
8. 重要な基本的注意
8.1 皮膚悪性腫瘍があらわれることがあるので、定期的に皮膚の状態を確認すること。また、皮膚の異常が認められた場合には、速やかに医療機関を受診するよう患者を指導すること。[11.1.1参照]
8.2 皮膚以外の部位に悪性腫瘍があらわれるおそれがあるので、観察を十分に行い、異常が認められた場合には、適切な処置を行うこと。
8.3 重篤な眼障害が報告されているので、定期的に眼の異常の有無を確認すること。また、眼の異常が認められた場合には、速やかに医療機関を受診するよう患者を指導すること。[11.1.2参照]
8.4 肝機能障害があらわれることがあるので、本剤投与中は定期的に肝機能検査を行い、患者の状態を確認すること。[11.1.4参照]
8.5 心機能障害があらわれることがあるので、本剤投与開始前及び本剤投与中は適宜心機能検査(心エコー等)を行い、患者の状態(左室駆出率(LVEF)の変動を含む)を確認すること。[9.1.1、11.1.3参照]
8.6 横紋筋融解症があらわれることがあるので、本剤投与中は定期的にCK、クレアチニン等の検査を行い、筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等に十分注意すること。[11.1.5参照]
8.7 高血圧クリーゼがあらわれることがあるので、血圧の推移等に十分注意して投与すること。[11.1.6参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.3 肝機能障害患者
本剤の減量を考慮するとともに、患者の状態をより慎重に観察し、副作用の発現に十分注意すること。本剤の血中濃度が上昇するとの報告がある。[16.6.1参照]
9.4 生殖能を有する者
妊娠可能な女性には、本剤投与中及び最終投与後一定期間、適切な避妊を行うよう指導すること。[9.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ラットを用いた動物試験において臨床曝露量の27倍に相当する用量で胎児体重の低値、骨化遅延又は骨格変異、ウサギを用いた動物試験において臨床曝露量の180倍に相当する用量で胎児体重の低値、骨化遅延が認められた。[9.4参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト乳汁中への移行は不明である。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を十分に観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
相互作用序文
本剤は主にCYP3A4により代謝される。[16.4.1参照]
薬物代謝酵素用語
CYP3A4
10.2 併用注意
[16.7.1参照] | 本剤の血中濃度が上昇し、副作用の発現が増強されるおそれがあるので、CYP3A阻害作用のない薬剤への代替を考慮すること。やむを得ずCYP3A阻害剤を併用する場合には、本剤の減量を考慮するとともに、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | これらの薬剤との併用により、本剤の代謝が阻害され、血中濃度が上昇するおそれがある。 |
[16.7.2参照] | OATP1B1、OATP1B3又はBCRPの基質となる薬剤と併用する場合は、これらの薬剤の血中濃度が上昇するおそれがある。 | 本剤がOATP1B1、OATP1B3及びBCRPを阻害することにより、これらの薬剤の血中濃度が上昇するおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 皮膚悪性腫瘍
基底細胞癌(0.3%)、ケラトアカントーマ(0.5%)、新たな原発性悪性黒色腫(頻度不明)等の皮膚悪性腫瘍があらわれることがある。[8.1参照]
11.1.2 眼障害
網膜障害(10.0%)、ぶどう膜炎(虹彩炎、虹彩毛様体炎を含む)(1.4%)等の眼障害があらわれることがある。[8.3参照]
11.1.3 心機能障害
11.1.4 肝機能障害
AST(4.1%)、ALT(5.2%)、γ-GTP(4.1%)、ビリルビン(0.5%)等の上昇を伴う肝機能障害があらわれることがある。[8.4参照]
11.1.5 横紋筋融解症(0.2%)[8.6参照]
11.1.6 高血圧(2.4%)、高血圧クリーゼ(0.2%)[8.7参照]
11.1.7 出血
消化管出血(2.7%)等の出血があらわれることがある。
11.1.8 手掌・足底発赤知覚不全症候群(7.9%)
悪性黒色腫に対する本剤の単独投与時にビニメチニブとの併用投与時と比較して、手掌・足底発赤知覚不全症候群等の発現頻度が増加する傾向が認められているので、ビニメチニブを中止し本剤を継続する場合は、観察を十分に行い、これらの事象の発現に十分に注意すること。
11.2 その他の副作用
| 5%以上 | 5%未満 | |
| 血液及びリンパ系障害 | 貧血 | リンパ球減少、好中球減少 |
| 心臓障害 | 動悸、期外収縮、僧帽弁閉鎖不全症 | |
| 耳及び迷路障害 | 耳鳴、回転性めまい | |
| 眼障害 | 霧視 | 眼瞼炎、色視症、眼乾燥、眼の障害、眼刺激、羞明、硝子体浮遊物、変視症、視力障害、結膜炎 |
| 胃腸障害 | 下痢(33.3%)、悪心(28.9%)、嘔吐、腹痛、便秘、口内炎 | 腹部不快感、腹部膨満、大腸炎、口内乾燥、消化不良、鼓腸、胃食道逆流性疾患、膵炎、アミラーゼ増加 |
| 全身障害 | 疲労(25.1%)、無力症、発熱 | 悪寒、冷感、インフルエンザ様疾患、浮腫(末梢性浮腫等)、末梢腫脹、全身健康状態低下、乾燥症、倦怠感 |
| 免疫系障害 | 過敏症 | |
| 感染症及び寄生虫症 | 毛包炎、爪真菌症、咽頭炎、ヘルペス感染、カンジダ感染、胃腸炎 | |
| 代謝及び栄養障害 | 食欲減退 | 高コレステロール血症、血中リン減少、高カリウム血症、高トリグリセリド血症、高尿酸血症、低アルブミン血症、リパーゼ増加、低ナトリウム血症 |
| 筋骨格系及び結合組織障害 | 関節痛、筋肉痛、血中CK増加 | 関節炎、背部痛、筋力低下、成長痛、筋骨格痛、四肢痛、頚部痛、四肢不快感、筋痙縮 |
| 精神・神経系障害 | 頭痛 | 顔面麻痺、視野欠損、不安、不眠症、睡眠障害、異常感覚、錯感覚、失神、傾眠、末梢性ニューロパチー、浮動性めまい、味覚異常 |
| 腎及び尿路障害 | 血中クレアチニン増加、頻尿 | |
| 呼吸器、胸郭及び縦隔障害 | 咳嗽、呼吸困難、胸水、発声障害 | |
| 皮膚及び皮下組織障害 | ざ瘡様皮膚炎(29.0%)、発疹(湿疹、丘疹等)(25.9%)、脱毛症、皮膚乾燥、過角化、そう痒症 | 皮膚炎、毛髪障害、毛質異常、多汗症、寝汗、光線過敏性反応、蕁麻疹、尋常性白斑、皮膚腫瘤、皮膚色素減少、皮膚色素過剰、脂肪織炎、紅斑、掌蹠角皮症、皮膚病変 |
| 血管障害 | 低血圧、ほてり | |
| その他 | メラノサイト性母斑 | 体重減少、体重増加、アクロコルドン、脂漏性角化症、乳頭腫、扁平上皮癌 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は吸湿性があるので、服用直前までPTPシートから取り出さないこと。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 ラットにおいて、臨床曝露量の3.3倍に相当する用量から雄性生殖器への影響(精細管変性、精子数減少等)が認められた。
15.2.2 カニクイザルにおいて、臨床曝露量の1.5倍に相当する用量で網膜への影響(黄斑部における網膜剥離)が認められた。
15.2.3 In vitro光毒性試験において陽性結果が得られた。
16. 薬物動態
16.1 血中濃度
16.1.1 反復投与
<BRAF遺伝子変異を有する根治切除不能な悪性黒色腫>
BRAF遺伝子変異を有する悪性黒色腫患者(6例)にエンコラフェニブ450mgを1日1回反復投与したときのエンコラフェニブの血漿中濃度推移及び薬物動態パラメータを以下に示す。エンコラフェニブの血漿中濃度は15日以内に定常状態に達し、累積係数は0.438倍であった1)(外国人データ)。
| 試験日(日) | Cmax(ng/mL) | Tmax(hr) | AUCtau(ng・hr/mL) | AUC0-∞(ng・hr/mL) | T1/2(hr) |
| 1(n=6) | 6650±3220 | 2(2,2.33) | 38500±24100 | 39100±25100 | 2.92(2.32,4.98) |
| 15(n=6) | 4330±2070 | 2(0.5,2) | 13800±5050 | 13900±5050 | 3.19(2.82,3.56) |
<がん化学療法後に増悪したBRAF遺伝子変異を有する治癒切除不能な進行・再発の結腸・直腸癌>
BRAF遺伝子変異を有する結腸・直腸癌患者(37例、日本人を含む)にビニメチニブ及びセツキシマブ(遺伝子組換え)との併用でエンコラフェニブ300mgを1日1回反復投与したときのエンコラフェニブの薬物動態パラメータを以下に示す2)。
| 試験日(日) | Cmax(ng/mL) | Tmax(hr) | AUClast(ng・hr/mL) |
| 1(n=34) | 3950±2270 | 2(0.883,6.25) | 13100±7170 |
| 29(n=29) | 3010±1750 | 2(0.950,5.73) | 7650±3980 |
16.2 吸収
16.2.1 食事の影響
健康成人(31例)にエンコラフェニブ100mgを空腹又は食後(高脂肪食)に単回投与注)したとき、空腹時と比較して、食後投与時のエンコラフェニブのCmax及びAUC0-∞はそれぞれ64.0及び95.9%であった3)(外国人データ)。
16.3 分布
エンコラフェニブのヒト血漿中蛋白結合率は86.1%、ヒト血液/血漿中濃度比は0.75であった4)(in vitro)。
16.4 代謝
16.4.1 In vitro
16.4.2 In vivo
健康成人(4例)に14C-エンコラフェニブ100mgを単回投与注)したとき、投与後24時間までの血漿中において、主に未変化体、M12.8(N-脱アルキル化及び加水分解を受けた代謝物のグルクロン酸抱合体)及びM42.5A(N-脱アルキル化体)が検出された(血漿中の総放射能に対する割合はそれぞれ27.5、23.0及び15.5%)7)(外国人データ)。
16.5 排泄
健康成人(4例)に14C-エンコラフェニブ100mgを単回投与注)したとき、投与後144時間までに投与放射能量の47.2%が糞中に、47.2%が尿中に排泄された。尿中には投与後48時間までに投与放射能の1.8%が未変化体として排泄された7)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
16.7 薬物相互作用
16.7.1 ポサコナゾール及びジルチアゼムとの併用
健康成人(16例)にポサコナゾール400mgの1日2回9日間反復投与時にエンコラフェニブ50mgを併用投与注)したとき、エンコラフェニブ単独投与時と比較して、エンコラフェニブのCmax及びAUC0-∞はそれぞれ168.4及び283.4%であった。また、健康成人(16例)にジルチアゼム240mgの1日1回4日間反復投与時にエンコラフェニブ50mgを併用投与注)したとき、エンコラフェニブ単独投与時と比較して、エンコラフェニブのCmax及びAUC0-∞はそれぞれ144.7及び183.0%であった9)(外国人データ)。[10.2参照]
16.7.2 ロスバスタチンとの併用
悪性腫瘍患者(10例)にエンコラフェニブ450mgを1日1回とビニメチニブ45mgを1日2回反復投与時にロスバスタチン10mgを併用投与(1日目、14日目)したとき、ロスバスタチン単独投与時と比較して、1日目のロスバスタチンのCmax及びAUC0-lastはそれぞれ434%及び279%、14日目のロスバスタチンのCmax及びAUC0-lastはそれぞれ268%及び157%であった(外国人データ)。[10.2参照]
16.7.3 その他
(1)ラべプラゾールとの併用
健康成人(11例)にエンコラフェニブ100mgをラべプラゾール20mgと併用注)したとき、エンコラフェニブ単独投与時と比較して、エンコラフェニブのCmax及びAUC0-∞はそれぞれ94.2及び96.6%であり、ラベプラゾール併用による胃内pH上昇はエンコラフェニブの薬物動態に影響を及ぼさなかった10)(外国人データ)。
(2)エンコラフェニブはCYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6及びCYP3Aを可逆的に阻害し、IC50値はそれぞれ22、1、20〜30、5、50、25及び8〜15μmol/Lであった(in vitro)。また、エンコラフェニブはCYP3Aを時間依存的に阻害し、KI値は20.5μmol/L、kinact値は0.0527min−1であった11)(in vitro)。
エンコラフェニブはCYP1A2、CYP2B6、CYP2C9を誘導した12)(in vitro)。エンコラフェニブはCYP3A4を誘導し、EC50値は10.2μmol/L、Emax値は169倍であった13)(in vitro)。
エンコラフェニブはCYP1A2、CYP2B6、CYP2C9を誘導した12)(in vitro)。エンコラフェニブはCYP3A4を誘導し、EC50値は10.2μmol/L、Emax値は169倍であった13)(in vitro)。
(3)エンコラフェニブはUGT1A1を阻害し、IC50値は1〜7μmol/Lであった14)(in vitro)。なお、エンコラフェニブはUGT1A1の基質であるビニメチニブの薬物動態に大きな影響を与えなかった(in vivo)。
注)本剤の承認された用法及び用量は、以下の通りである。
<BRAF遺伝子変異を有する根治切除不能な悪性黒色腫>
ビニメチニブとの併用において、通常、成人にはエンコラフェニブとして450mgを1日1回経口投与する。
<がん化学療法後に増悪したBRAF遺伝子変異を有する治癒切除不能な進行・再発の結腸・直腸癌>
セツキシマブ(遺伝子組換え)との併用、又はビニメチニブ及びセツキシマブ(遺伝子組換え)との併用において、通常、成人にはエンコラフェニブとして300mgを1日1回経口投与する。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<BRAF遺伝子変異を有する根治切除不能な悪性黒色腫>
17.1.1 国際共同第III相試験(CMEK162B2301試験)
BRAF V600E/K変異を有する根治切除不能な悪性黒色腫患者577例(日本人患者11例を含む。本剤とビニメチニブの併用投与群192例、ベムラフェニブ群191例、本剤単独投与群194例)を対象に、ベムラフェニブを対照として本剤(450mg※1を1日1回)とビニメチニブ(1回45mgを1日2回)を併用投与したときの有効性及び安全性を検討した。主要評価項目である中央判定による無増悪生存期間(中央値[95%信頼区間])の主要解析結果は、本剤とビニメチニブ併用投与群で14.9[11.0〜18.5]ヵ月、ベムラフェニブ群で7.3[5.6〜8.2]ヵ月であり、本剤とビニメチニブの併用投与はベムラフェニブに対し統計学的に有意な延長を示した(ハザード比0.54[95%信頼区間:0.41〜0.71]、p<0.0001[層別log-rank検定]、2016年5月19日データカットオフ)20)。また、安全性評価対象となった192例中169例(88.0%)に副作用(臨床検査値の異常を含む)が認められた。主な副作用は、悪心59例(30.7%)、下痢52例(27.1%)、疲労48例(25.0%)、血中CK増加41例(21.4%)であった。[7.2参照]
※1:本剤単独投与時の忍容性を検討した国際共同第I相試験の結果、1日1回450mg投与で認められた用量制限毒性に基づき、次相以降の本剤単独投与の推奨用量は1日1回300mg投与と決定された一方、CMEK162B2301試験では、ビニメチニブを休薬又は中止した場合にも本剤は減量せずに継続することが可能な規定とされた。
<がん化学療法後に増悪したBRAF遺伝子変異を有する治癒切除不能な進行・再発の結腸・直腸癌>
17.1.2 国際共同第III相試験(ARRAY-818-302試験)
一次治療又は二次治療後に増悪したBRAF V600E変異を有する治癒切除不能な進行・再発の結腸・直腸癌患者665例(日本人患者20例を含む)を対象に、FOLFIRI※2及びセツキシマブ※3の併用投与又はイリノテカン※4及びセツキシマブ※3の併用投与(対照群)を対照として[1]本剤※5、ビニメチニブ※6及びセツキシマブ※3の併用投与(3剤群)又は[2]本剤※5及びセツキシマブ※3の併用投与(2剤群)の有効性及び安全性を検討した。主要評価項目である全生存期間及び奏効率の結果※7を以下に示す。対照群に対して3剤群及び2剤群は、全生存期間を統計学的に有意に延長し、奏効率は統計学的に有意に高値であった(2019年2月11日データカットオフ)2)。また、3剤群及び2剤群においてそれぞれ安全性評価対象となった222例中208例(93.7%)及び216例中191例(88.4%)に副作用(臨床検査値の異常を含む)が認められた。主な副作用は、3剤群で下痢118例(53.2%)、ざ瘡様皮膚炎107例(48.2%)、悪心79例(35.6%)、疲労61例(27.5%)、嘔吐57例(25.7%)、2剤群でざ瘡様皮膚炎60例(27.8%)、疲労49例(22.7%)、悪心44例(20.4%)であった。
※2:2週間を1サイクルとして、第1日目に[1]イリノテカン180mg/m2を90分かけて静脈内投与、[2]ホリナート400mg/m2を120分かけて静脈内投与、[3]フルオロウラシル400mg/m2を急速静脈内投与した後、フルオロウラシル2,400mg/m2を46〜48時間かけて静脈内投与
※3:初回のみ400mg/m2を120分かけて、その後250mg/m2を60分かけて毎週静脈内投与
※4:2週間を1サイクルとして、180mg/m2を90分かけて静脈内投与
※5:300mgを1日1回投与
※6:1回45mgを1日2回投与
※7:本試験では、主要目的として、対照群に対する3剤群の奏効率及び全生存期間の優越性が検証された後、階層的な検定手順に従い、副次目的である対照群に対する2剤群の全生存期間及び奏効率の解析が実施された
| 3剤群 | 2剤群 | 対照群 | ||
| 全生存期間 | 症例数 | 224例 | 220例 | 221例 |
| 中央値(月)[95%信頼区間] | 9.0[8.0,11.4] | 8.4[7.5,11.0] | 5.4[4.8,6.6] | |
| ハザード比※8[95%信頼区間] p値※9 | 0.52[0.39,0.70] <0.0001 | 0.60[0.45,0.79] 0.0002 | − | |
| 奏効率※10 | 症例数※11 | 111例 | 113例 | 107例 |
| 奏効率(%)[95%信頼区間] | 26.1[18.2,35.3] | 20.4[13.4,29.0] | 1.9[0.2,6.6] | |
| p値※12 | <0.0001 | <0.0001 | − | |
なお、部分集団解析による2剤群に対する3剤群のハザード比[95%信頼区間]※13は、ECOG PS1の集団(3剤群109例、2剤群107例)で0.71[0.51,0.99]、転移臓器数≧3の集団(3剤群111例、2剤群103例)で0.63[0.45,0.90]、CRP値>1mg/dLの集団(3剤群95例、2剤群79例)で0.65[0.46,0.92]、原発巣が未切除又は不完全切除の集団(3剤群91例、2剤群97例)で0.55[0.38,0.79]であり、3剤群でOSが良好な傾向が認められた。一方、ECOG PS 0の集団(3剤群115例、2剤群113例;0.99[0.66,1.47])、転移臓器数≦2の集団(3剤群113例、2剤群117例;1.04[0.72,1.50])、CRP値≦1mg/dLの集団(3剤群122例、2剤群139例);1.02[0.71,1.46])、原発巣が完全切除の集団(3剤群133例、2剤群123例);1.00[0.71,1.41])では、2剤群と3剤群のOSは同程度であった(2019年8月15日データカットオフ)。
※13:全体集団において単変量Cox回帰モデル等により同定された、OSに影響を及ぼすと考えられる5つの患者背景因子(CRP値>1mg/dL、肝転移あり、CEA値>5μg/L、CA19-9値>35U/mL及び転移臓器数≧3)で調整した結果
18. 薬効薬理
18.1 作用機序
エンコラフェニブは、ヒトBRAF V600Eのキナーゼ活性を阻害した21)。また、エンコラフェニブは、BRAF V600E変異を有するヒト悪性黒色腫由来A375細胞株において、MAPK経路のシグナル伝達分子(MEK及びERK)のリン酸化を阻害した22)23)。
18.2 抗腫瘍効果
18.2.1 In vitro
エンコラフェニブは、BRAF V600E変異を有するヒト悪性黒色腫由来A375細胞株及びBRAF V600E変異を有するヒト結腸・直腸癌由来細胞株(COLO 205、HT-29等)の増殖を抑制した24)25)。また、エンコラフェニブとMEK阻害剤であるビニメチニブとの併用により、各薬剤単独と比較して、BRAF V600E変異を有するヒト悪性黒色腫由来細胞株(A375、COLO 800等)、BRAF V600K変異を有するヒト悪性黒色腫由来IGR-1細胞株、BRAF V600E変異を有するヒト結腸・直腸癌由来細胞株(COLO 205、HT-29等)に対する増殖抑制作用が増強した26)27)。
18.2.2 In vivo
エンコラフェニブは、A375細胞株及びCOLO 205細胞株を皮下移植したヌードマウスにおいて、腫瘍増殖抑制作用を示した28)29)。また、エンコラフェニブとビニメチニブとの併用により、各薬剤単独と比較して、BRAF V600E変異を有するヒト悪性黒色腫患者由来HMEX1906腫瘍組織片を皮下移植したヌードマウスにおける腫瘍増殖抑制作用が増強した30)。さらに、[1]エンコラフェニブとセツキシマブとの併用、並びに[2]エンコラフェニブ、ビニメチニブ及びセツキシマブの併用により、[1]セツキシマブ単独及び[2]エンコラフェニブ又はセツキシマブ単独と比較して、HT-29細胞株を皮下移植したヌードマウスにおける腫瘍増殖抑制作用がそれぞれ増強した31)。
19. 有効成分に関する理化学的知見
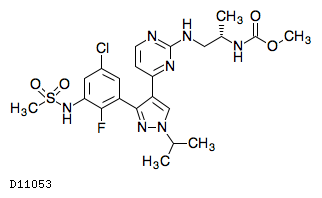
19.1. エンコラフェニブ
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
<BRAF遺伝子変異を有する根治切除不能な悪性黒色腫>
21.2 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
<ビラフトビカプセル50mg>
42カプセル[6カプセル(PTP)×7]
60カプセル[6カプセル(PTP)×10]
<ビラフトビカプセル75mg>
42カプセル[6カプセル(PTP)×7]
23. 主要文献
- 小野薬品工業:海外第I相(CLGX818X2101)試験成績(社内資料;2019年1月8日承認、CTD2.7.6.10、CTD2.7.2.2.1.2)
- 小野薬品工業:国際共同第III相(ARRAY-818-302)試験成績(社内資料;2020年11月27日承認、CTD2.7.6.6、CTD2.7.2.2.3.1)
- 小野薬品工業:海外第I相(ARRAY-818-102)試験成績(社内資料;2019年1月8日承認、CTD2.7.6.1、CTD2.7.1.2)
- 小野薬品工業:In vitro血漿蛋白結合及び血球移行性(社内資料;2019年1月8日承認、CTD2.7.2.2)
- 小野薬品工業:In vitro代謝(社内資料;2019年1月8日承認、CTD2.7.2.2、CTD2.7.2.3)
- 小野薬品工業:代謝酵素の推定(社内資料;2019年1月8日承認、CTD2.7.2.2、CTD2.7.2.3)
- 小野薬品工業:海外マスバランス(CLGX818A2101)試験成績(社内資料;2019年1月8日承認、CTD2.7.6.6)
- 小野薬品工業:肝機能障害患者における海外第I相(ARRAY-818-101)試験成績(社内資料;2019年1月8日承認、CTD2.7.6.13、CTD2.7.2.2.1.2)
- 小野薬品工業:海外第I相(ARRAY-818-105)試験成績(社内資料;2019年1月8日承認、CTD2.7.6.18、CTD2.7.2.2.1.2)
- 小野薬品工業:海外第I相(ARRAY-162-105)試験成績(社内資料;2019年1月8日承認、CTD2.7.6.15、CTD2.7.2.2.1.2)
- 小野薬品工業:CYP阻害作用(社内資料;2019年1月8日承認、CTD2.7.2.2)
- 小野薬品工業:CYP誘導作用(1)(社内資料;2019年1月8日承認、CTD2.7.2.2)
- 小野薬品工業:CYP誘導作用(2)(社内資料;2019年1月8日承認、CTD2.7.2.2)
- 小野薬品工業:UGT1A1阻害作用(社内資料;2019年1月8日承認、CTD2.7.2.2)
- 小野薬品工業:トランスポーター基質検討(社内資料;2019年1月8日承認、CTD2.7.2.2)
- 小野薬品工業:排出トランスポーター阻害作用(社内資料;2019年1月8日承認、CTD2.7.2.2)
- 小野薬品工業:肝取込みトランスポーター阻害作用(1)(社内資料;2019年1月8日承認、CTD2.7.2.2)
- 小野薬品工業:肝取込みトランスポーター阻害作用(2)(社内資料;2019年1月8日承認、CTD2.7.2.2)
- 小野薬品工業:腎取込みトランスポーター阻害作用(社内資料;2019年1月8日承認、CTD2.7.2.2)
- 小野薬品工業:国際共同第III相(CMEK162B2301)試験成績(社内資料;2019年1月8日承認、CTD2.7.6.19、CTD2.7.6.20)
- 小野薬品工業:BRAFに対する阻害活性(社内資料;2019年1月8日承認、CTD2.6.2.2)
- 小野薬品工業:MEKのリン酸化に対する阻害作用(社内資料;2019年1月8日承認、CTD2.6.2.2)
- 小野薬品工業:ERKのリン酸化に対する阻害作用(社内資料;2019年1月8日承認、CTD2.6.2.2)
- 小野薬品工業:BRAF変異ヒト悪性黒色腫細胞の増殖に対する抑制作用(社内資料;2019年1月8日承認、CTD2.6.2.2)
- 小野薬品工業:BRAF変異ヒト結腸・直腸癌細胞の増殖に対する抑制作用(社内資料;2020年11月27日承認、CTD2.6.2.2)
- 小野薬品工業:BRAF変異ヒト悪性黒色腫細胞の増殖に対するビニメチニブとの併用効果(社内資料;2019年1月8日承認、CTD2.6.2.2)
- 小野薬品工業:BRAF変異ヒト結腸・直腸癌細胞の増殖に対するビニメチニブとの併用効果(社内資料;2020年11月27日承認、CTD2.6.2.2)
- 小野薬品工業:BRAF変異ヒト悪性黒色腫細胞移植マウスにおける抗腫瘍効果(社内資料;2019年1月8日承認、CTD2.6.2.2)
- 小野薬品工業:BRAF変異ヒト結腸・直腸癌細胞移植マウスにおける抗腫瘍効果(社内資料;2020年11月27日承認、CTD2.6.2.2)
- 小野薬品工業:BRAF変異ヒト悪性黒色腫細胞移植マウスにおけるビニメチニブとの併用効果(社内資料;2019年1月8日承認、CTD2.6.2.2)
- 小野薬品工業:BRAF変異ヒト結腸・直腸癌細胞移植マウスにおけるビニメチニブ及びセツキシマブとの併用効果(社内資料;2020年11月27日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
小野薬品工業株式会社 くすり相談室
〒541-8564 大阪市中央区久太郎町1丁目8番2号
電話:0120-626-190
製品情報問い合わせ先
小野薬品工業株式会社 くすり相談室
〒541-8564 大阪市中央区久太郎町1丁目8番2号
電話:0120-626-190
26. 製造販売業者等
26.1 製造販売
小野薬品工業株式会社
大阪市中央区久太郎町1丁目8番2号
26.2 提携
ARRAY
填写下方邮箱进行订阅,即可获取详细说明书,另有机会获得全处方辅料含量及部分COA等!
更多信息
你必须登录或注册一个新账户,以便接触產品
有用的信息
- 仅对制药厂、医药研发公司、医药研究所、医院服务,不对个人开放!

 请用手机扫二维码
请用手机扫二维码












必须要注册或登陆才可以发表评论
我们提供全球参比制剂,有需要可以评论留言
登录 注册